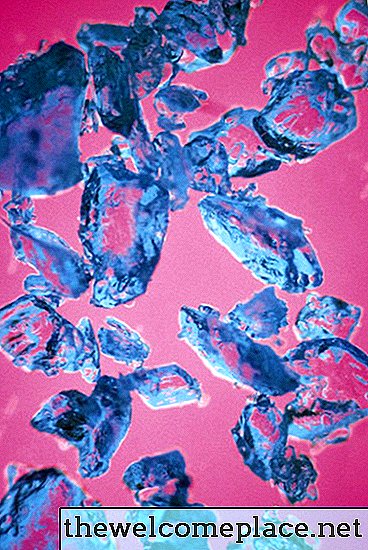
Stejně jako mnoho komplexů přechodných kovů je pentahydrát síranu měďnatého jasně zbarvený; krystaly této krásné látky jsou bledě modré barvy. Jeho barva pramení z chemie a fyziky jeho složení - nebo přesněji z druhu vazeb, které tvoří s síranovými ionty a molekulami vody navázanými na měď.
 Pentahydrát síranu měďnatého má nádhernou průsvitnou modrou barvu.
Pentahydrát síranu měďnatého má nádhernou průsvitnou modrou barvu.Orbitaly
Elektrony vykazují dualitu vlnových částic, což znamená, že mají jak vlnové vlastnosti, tak vlastnosti podobné částicím. Chování elektronu v atomu je popsáno vlnovou rovnicí zvanou vlnová funkce. Čtverec vlnové funkce dává pravděpodobnost, že elektron bude nalezen v kterémkoli konkrétním bodě v kterémkoli daném čase. Vlnové funkce elektronů v atomech se také nazývají atomové orbitaly. Chemici pojmenovávají atomové orbity pomocí čísla k označení energetické úrovně orbitálu, po němž následuje písmeno označující typ orbitálu. U prvků ve čtvrté periodě periodické tabulky nebo vyšší se musíte soustředit pouze na tři typy orbitálů, jmenovitě s, p a d. Chcete-li získat cit pro tvar těchto orbitálů, podívejte se na odkaz v sekci zdrojů.
Rozdělení křišťálového pole
Ion mědi v síranu měďnatého ztratil dva elektrony, takže má +2 náboj. Má devět elektronů ve své nejvzdálenější energetické úrovni nebo plášti; tito takzvaní valenční elektrony všichni zabírají 3d orbitaly. Molekuly vody a síranové ionty jsou přitahovány k kladnému náboji na měděném iontu, takže se k němu přibližují a uspořádají kolem sebe v oktaedrální konfiguraci. V důsledku toho se dva z pěti 3D orbitálů měděného iontu zarovnají podél os, kterými se ionty síranu a molekuly vody přibližují; protože elektrony v těchto orbitálech a elektrony v molekulách / iontech mají negativní náboj, odpuzují se navzájem. Nakonec tedy dva z pěti 3D orbitálů zvýšili energii; nazývají se např. orbitaly. Ostatní tři naopak mají sníženou energii a nazývají se t2g orbitaly.
Absorpce světla
Foton světla bude absorbován koordinačním komplexem, pokud má energii ekvivalentní rozdílu mezi stavem, který nyní elektron zaujímá, a energií jiného stavu, který má k dispozici. V důsledku toho může komplex síranu mědi absorbovat fotony světla s energií ekvivalentními rozdílu v energii mezi t2g a např. Orbitaly. Jak se to stane, rozdíl energie pro komplex síranu měďnatého je ekvivalentní rozdílu energie pro fotony světla v červenooranžové oblasti spektra. Protože se červené světlo absorbuje, zatímco je přenášeno modré světlo, zdá se síran měďnatý modrý.
Rozpouštění ve vodě
Když se síran mědi rozpustí ve vodě, ionty mědi a síranu se disociují. Nyní měděný iont tvoří oktaedrální komplex, kde je obklopen šesti molekulami vody. Účinek je však stále stejný, protože rozdělení mezi t2g orbitaly a např. Orbitaly v tomto novém komplexu je stále takové, že se absorbuje červeno-oranžové světlo a uvidíte modré řešení.